- A+
光免疫疗法(Photoimmunotherapy)将肿瘤的光动力疗法与免疫疗法相结合,利用光激活产生的活性氧(Reactive oxygen species, ROS)诱导免疫原性细胞死亡(Immunogenic cell death, ICD),从而激发机体自身免疫反应攻击并清除肿瘤细胞。然而,高活性ROS的非特异性释放会造成正常组织的氧化损伤,限制光免疫治疗的临床应用。因此,开发ROS的精准控释策略对于光免疫疗法的发展具有重要意义。 近日,华东理工大学杨有军教授、华东师范大学钱旭红院士、罗潇研究员和陈缙泉教授、上海中医药大学葛广波教授以及上海交通大学医学院附属第九人民医院闵沛如医生合作,在肿瘤光免疫治疗策略的开发上取得重要进展。研究团队提出了一种新的生物氧化还原调控策略——生成后自由基强化(post-generation radical reinforcement)。其核心在于,光照后首先生成非氧化性或中等氧化性物种(如ONOO-),随后将其激活成高氧化性自由基以诱发ICD。通过这一策略实现更精准可控的ROS释放,减少正常组织的非特异性氧化损伤。 针对这一策略,研究团队创制了碳光笼化罗丹明分子骨架——NPCD565,并基于此开发了一种荧光自报告型的光控亚硝酰过氧碳酸根(ONOOCO2-)供体分子。
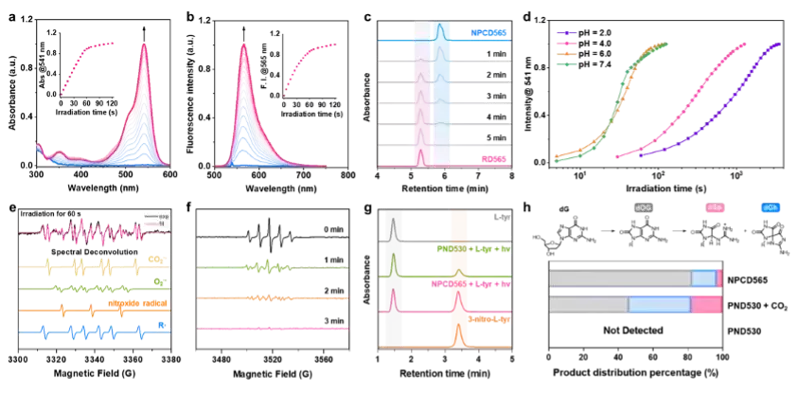
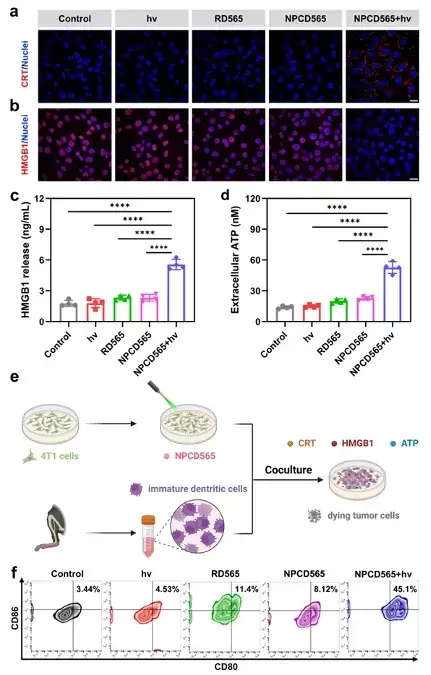
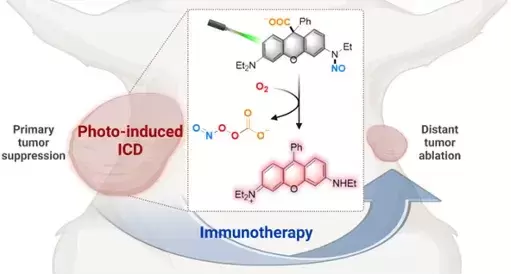
图1 光激活ONOOCO2-供体的分子机制 亚硝酰过氧碳酸根供体NPCD565可被紫外至红光全波段激活,高效释放ONOOCO2-,随后均裂为二氧化氮(NO2)和碳酸根阴离子自由基(CO3•-),实现自由基鸡尾疗法。ONOOCO2-释放伴随荧光染料罗丹明(RD565)同步生成,用于ONOOCO2-释放位点、释放动力学和剂量的高时空分辨可视化,为光免疫疗法的精准实施提供了有力分子工具。 图2 光激活ONOOCO2-供体的机制验证 在三阴性乳腺癌4T1细胞中,光激活NPCD565产生的ONOOCO2-能够诱导垂死肿瘤释放出ICD的损伤相关分子模式(DAMPs),促使树突状细胞成熟,激活机体的免疫反应,从而进一步增强对癌细胞的攻击。在双侧荷瘤小鼠模型中,光激活NPCD565对原发肿瘤和远端转移肿瘤均表现出显著的生长抑制作用。 图3 光激活ONOOCO2-释放诱发细胞免疫原性死亡 这项研究不仅揭示了ONOOCO2-的强大免疫原性,还展示了其供体NPCD565在光免疫疗法中的广阔潜力,为临床肿瘤免疫治疗提供了新的治疗策略及分子工具。 论文信息 A Carbon-Caged Rhodamine Generating Nitrosoperoxycarbonate for Photoimmunotherapy Lei Yin, Bei Zhao, Jie Zhou, Yunxia Huang, Hao Ma, Ting Zhou, Jie Mou, Dr. Peiru Min, Prof. Jinquan Chen, Prof. Guangbo Ge, Prof. Xuhong Qian, Prof. Xiao Luo and Prof. Youjun Yang 华东理工大学博士生尹蕾、上海中医药大学赵蓓和华东师范大学博士生周婕为文章的第一共同作者。 罗潇研究员课题组聚焦生物氧化还原的化学精准调控,立足荧光染料母核,通过分子机制创新,开发疾病预防、诊断和治疗的分子工具。 杨有军教授课题组主要聚焦红外荧光染料及生物活体成像、功能荧光染料及生物氧化还原调控。 Angewandte Chemie International Edition DOI: 10.1002/anie.202402949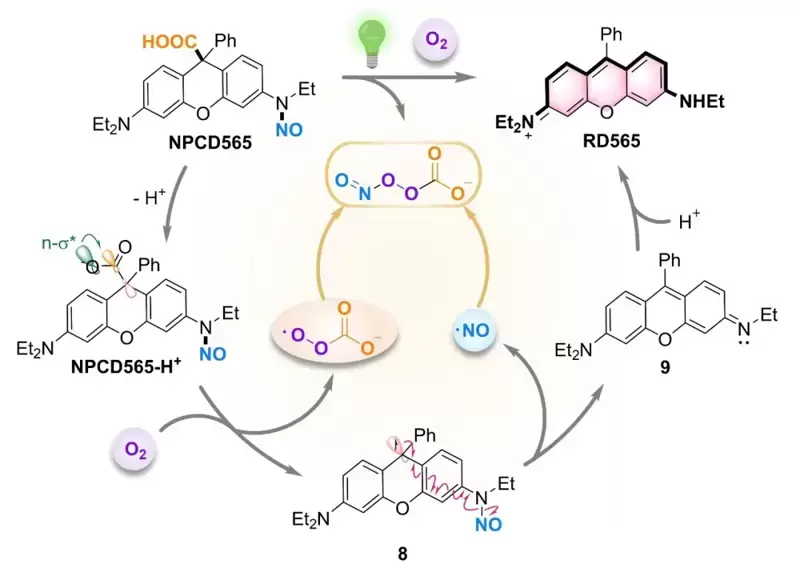


目前评论: