- A+
氮杂阻旋异构体在天然产物全合成、医药农药开发以及新型功能材料等领域都有很多重要的应用,并且其旋转受阻的N–X轴(N–N或者N–C)对分子的理化性质和生物活性往往具有重要的影响。比如喹诺酮磺酰胺I对钠离子通道NaV1.7的抑制效果是其阻旋异构体的100倍,PDE4抑制剂II比其阻旋异构体具有更高的代谢稳定性,Dixiamycin A (III)对于多种细菌的抑制效果也远高于Dixiamycin B.(图1)。尽管N–X轴手性分子的不对称合成取得了快速的发展,但目前发展的方法大多只能单一地构建N–C或者N–N轴手性,发展更高效、普适的合成方法以兼容这两类轴手性具有重要意义。
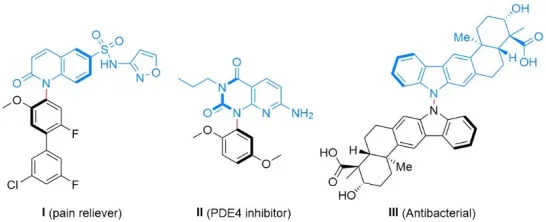
图1 N–X阻旋异构体
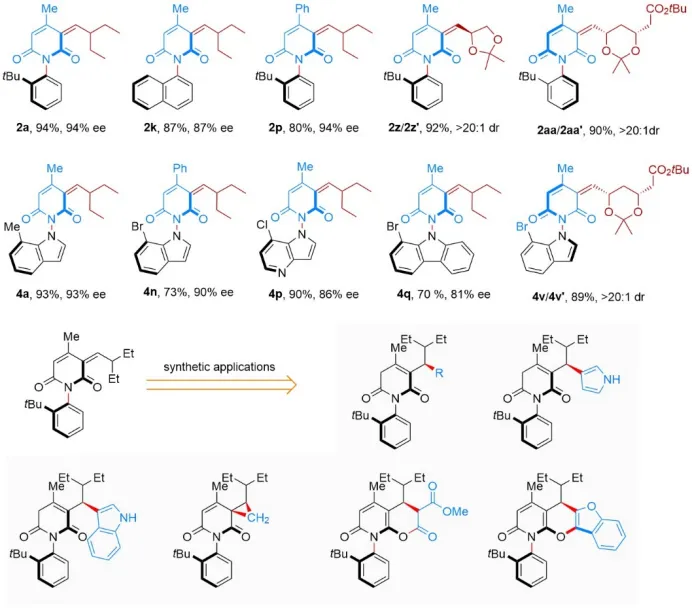
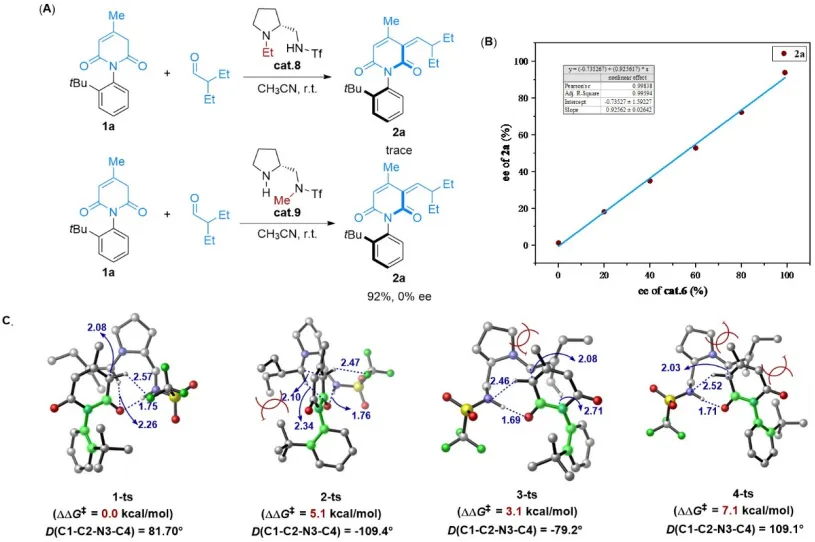
动态动力学不对称转化(DYKAT)是构建轴手性的重要策略。Lassaletta、Virgil、肖文精、曹志超以及余达刚等课题组先后利用环金属中间体,通过动态动力学不对称偶联反应、Heck反应以及羧基化反应等,实现了联芳基杂环分子的多样化合成(图2A)。郑州大学邓瑞显课题组一直致力于氮杂阻旋异构体的多样性合成(Angew. Chem. Int. Ed. 2024, 63, e202402231)。最近,该课题组通过动态动力学不对称Knoevenagel反应,实现了N–C和N–N轴手性1,3-吡啶二酮化合物的高效合成(图2B)。反应中,醛首先与脯氨酸衍生的催化剂形成亚胺阳离子中间体,并通过去质子化使底物形成对称的烯醇负离子,二者通过氢键连接并创造手性的环境,实现烯醇负离子多个反应位点的精确识别,远程控制N–X轴手性。 图2 对称阴离子介导的动态动力学不对称Knoevenagel反应 温和的条件使反应对各类官能团都能很好地兼容,高立体选择性得到官能团多样的N–C和N–N轴手性1,3-吡啶二酮化合物(图3)。多种重要的手性醛化合物在该反应中同样兼容,并且利用醛的立体中心与催化剂配合可以进一步提高反应的对映选择性。此外,通过简单的衍生化反应,如Michael加成反应、傅-克烷基化反应以及环加成反应,可以方便地合成各种复杂的碳氮轴手性分子。 图3 底物拓展和衍生化 最后,作者进一步研究了反应的立体选择性控制机制(图4)。对照实验中催化剂8的活性很低,证明二级胺参与了催化循环而不是仅作为碱对底物进行去质子化。而催化剂9的活性虽然很高,但产物ee值为0,表明反应中氢键对于立体选择性的控制非常关键。河南农业大学的薛晓平老师对反应进行了密度泛函理论计算,反应中N–H···O氢键将烯醇负离子和亚胺离子中间体连接起来,并构建了手性环境,其中环戊基和甲基的相互排斥,使得反应更有利于正面加成,而3-丁基和叔丁基的相互排斥使反应得到S构型产物。 图4 对照实验和理论计算 总之,邓瑞显课题组通过对称阴离子介导的动态动力学不对称Knoevenagel反应,构建N–C和N–N轴手性1,3-吡啶二酮分子,为合成C–X阻旋异构体提供了新的策略。 论文信息 Symmetric Anion Mediated Dynamic Kinetic Asymmetric Knoevenagel Reaction for N−C and N−N Atropisomers Synthesis Hongyu Qu, Chenyang Huo, Jimeng Ge, Dr. Xiaoping Xue, Prof. Dr. Zhenhua Gu, Dr. Ruixian Deng Angewandte Chemie International Edition DOI: 10.1002/anie.202410012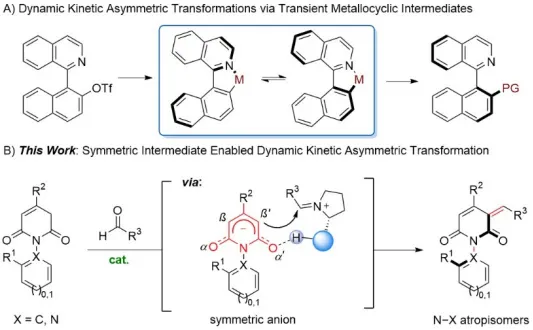


目前评论: