- A+
在手性Brønsted酸催化剂发展过程中,手性磷酸催化体系得到了极大的发展。虽然酒石酸和扁桃酸这些简单羧酸广泛存在于自然界中,但是将这些手性羧酸应用于不对称催化反应的研究却报道较少,这主要是由于这些简单羧酸酸性较弱,不能有效活化底物。事实上,正如Maruoka课题组所报道的那样,手性羧酸参与的不对称反应往往需要增加手性羧酸催化剂的酸性。近期,美国佛罗里达大学的Daniel Seidel课题组报道了一种新型的共轭碱稳定的手性羧酸催化剂,该催化剂通过阴离子对结合,可以实现许多不对称转化。通过计算作者发现,催化剂的阴离子部分可以形成一种碗型构象,易于与底物的阳离子部分结合。这些前期设计主要集中于1,2-二胺骨架,但这种骨架相对难以合成。最近,该课题组采用1,2-手性氨基醇骨架替代1,2-二胺骨架设计出了第二代手性羧酸催化剂,不仅易于合成,而且催化活性和选择性均有提高(Figure 1)。相关研究成果发表在J. Am. Chem. Soc.上(DOI: 10.1021/jacs.0c07212)。

(来源:J. Am. Chem. Soc.)
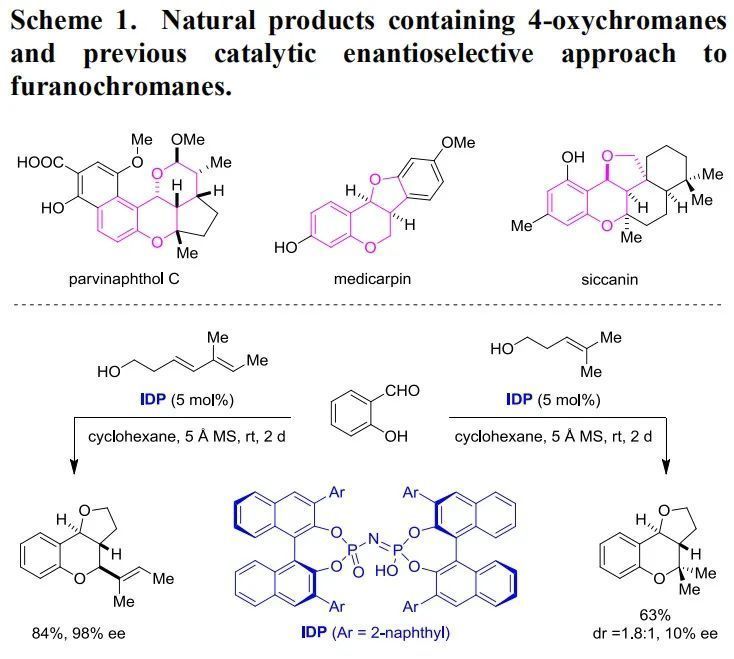
呋喃并苯并二氢吡喃或吡喃并苯并二氢吡喃结构在天然产物中广泛存在,如parvinaphthol C、medicarpin和 siccanin结构中均有这些片段(Scheme 1,上)。虽然有许多方法可以实现没有4位氧原子的苯并二氢吡喃化合物的合成,但是直接催化不对称合成具有4位氧原子的苯并二氢吡喃化合物的报道却很少。虽然Brønsted酸和Lewis酸可以高收率、高非对映选择性地催化合成呋喃并苯并二氢吡喃或吡喃并苯并二氢吡喃化合物,但是实现这个过程的手性控制过程直到最近才被List课题组所报道(Scheme 1,下)。然而,List课题组的亚胺二磷酸(IDP)催化体系底物范围仅限于共轭的烯烃,因此,实现简单烯烃底物的[4+2]不对称环化反应任重而道远。
(来源:J. Am. Chem. Soc.)
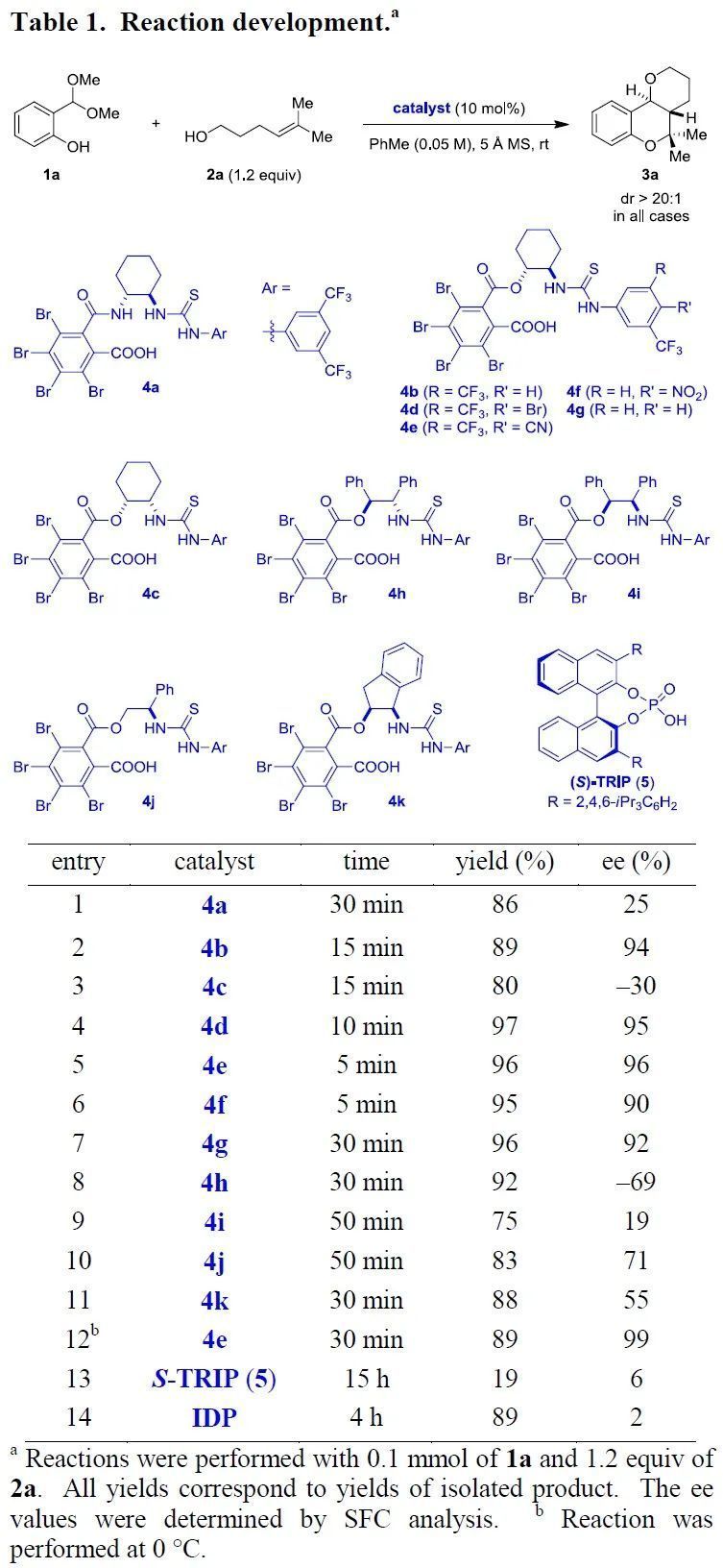
在本研究中,首先作者采用水杨醛二甲基缩醛1a与高高烯丙基醇2a为模板底物进行条件优化(Table 1)。通过对催化剂、温度等反应条件的筛选,作者确定了该反应的最优条件为:4e为手性羧酸催化剂、甲苯为溶剂、5 Å分子筛为添加剂,底物在室温下反应5 min,最终可以96%的收率与96%的ee值得到目标产物3a。将反应温度降至0 ℃,反应30 min后产物3a的收率可达89%,ee值高达99%。尽管4e是底物2a的最佳催化剂,但作者发现4b的底物适用范围更为广泛。此外,值得一提的是,这类催化剂易于制备且性质稳定。
(来源:J. Am. Chem. Soc.)
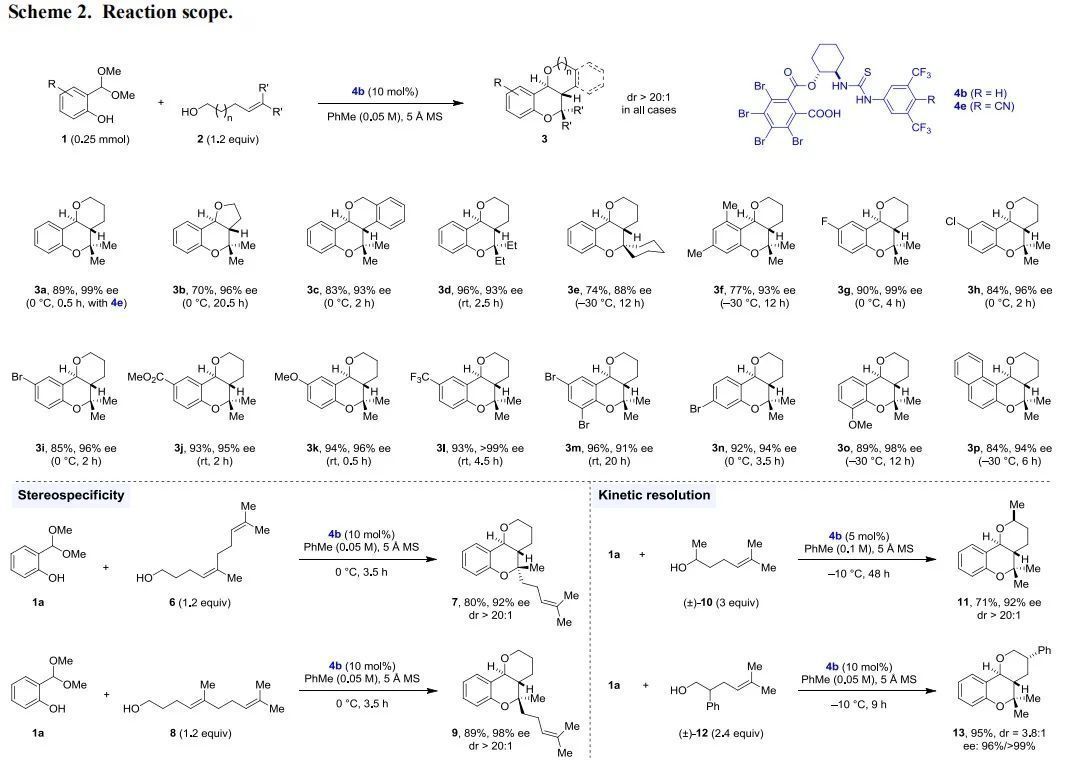
接下来,作者对反应的底物范围进行了扩展(Scheme 2,上)。具有高高烯丙醇、高烯丙醇、苄醇片段的烯烃均能有效参与反应,反应对于缩醛底物中的各类取代官能团也能很好地兼容。重要的是,在这些反应中,均得到反式的非对映异构体。当采用不同构型的烯烃时,反应也会得到不同构型的非对映异构体,这可能是经过了Prins反应类似的过程,使得反应具有良好的立体专一性(Scheme 2,左下)。利用这个性质,作者随后也实现了这个反应的动力学拆分过程与非对映异构体的发散性合成(Scheme 2,右下)。
(来源:J. Am. Chem. Soc.)
为了进一步提高反应的效率,作者对反应的浓度及催化剂用量进行了进一步筛选,发现当反应浓度增加10倍时,催化剂用量仅需0.5 mol%。
最后,作者对这一系列催化剂进行了酸度测定,发现:1)通过共轭碱稳定的羧酸酸性大大增加;2)催化剂中酰胺的NH并不是影响酸性的主要基团;3)催化剂的酸性与催化反应活性并不是完全成正相关;4)催化剂的顺式异构体更加稳定。
小结:Daniel Seidel课题组通过发展新型羧酸催化剂,实现了缩醛参与的[4+2]不对称环加成反应,高效合成了一系列呋喃并苯并二氢吡喃或吡喃并苯并二氢吡喃化合物。新型共轭碱稳定的羧酸催化剂是实现这个转化的关键。


目前评论: